Virusbasierte Impfstoffherstellung
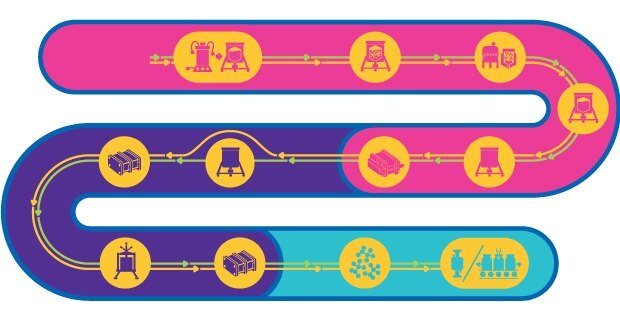
Prozesslinie für inaktivierte & lebend-attenuierte Viren
Virusbasierte Impfstoffe bestehen entweder aus attenuierten oder inaktivierten Viren. Diese Impfstoffe können alle Phasen des Immunsystems aktivieren und bieten eine schnelle und dauerhafte Langzeitimmunität, indem sie die Bildung neutralisierender Antikörper gegen den Zielerreger anregen.
Das Verfahren zur Herstellung von Impfstoffen auf Basis attenuierter Viren ist komplex, besteht aus mehreren Schritten und muss das infektiöse Potenzial des attenuierten Virus erhalten. Für die Herstellung gibt es zwar einen generellen Workflow, jedoch keinen Template-basierten Ansatz. Stattdessen muss jedes Verfahren auf Form, Größe, Art, das physikalisch-chemische Verhalten, Stabilität und Wirtsspezifität des Virus zugeschnitten sein.
Weitere Informationsquellen
Biopharmaceutical Applications Guide
Broschüre: Vaccine Bioprocessing Handbook
Mini-Handbuch: Cell-Based Vaccine Bioprocessing
Broschüre: Enabling Solutions for Vaccines and Viral Therapies
Whitepaper: Filtration Strategies for Optimal Development and Purification of a Foot and Mouth Disease Virus
Whitepaper: Downstream Process Intensification for Virus Purification Using Membrane Chromatography
Anwendungshinweis: Effect of Benzonase® Endonuclease Addition to Purification of Sabin Polio Virus Type 3
Technischer Artikel: Choosing the Optimal Cell Culture Media for Vaccine Production
Technischer Artikel: Choosing the Optimal Vaccine Adjuvant
Artikel: Nucleic Acid Impurity Reduction in Viral Vaccine Manufacturing
Artikel: Filter-Based Clarification of Viral Vaccines and Vectors
Optimieren Sie Upstream-Produktivität und Klärfiltration mit zuverlässiger Skalierung
Die für die Herstellung von Impfstoffen auf Virusbasis entwickelten Upstream-Kulturverfahren müssen optimiert werden, um den Produktivitätsanforderungen gerecht zu werden. Diese Optimierung schließt den Klärfiltrationsschritt ein, der für die Entfernung von Zellen und Zelltrümmern und zur Sicherstellung einer robusten Virusernte unerlässlich ist. Der Upstream-Prozess ist jedoch nur dann erfolgreich, wenn er zuverlässig skaliert werden kann, um damit der antizipierten Marktnachfrage gerecht zu werden.
Erreichen von Ausbeute- und Effizienzzielen durch robuste Abscheidung von Verunreinigungen
Nukleinsäuren aus lysierten Zellen sind eine häufig auftretende Kontaminante in virusbasierten Impfstoffprozessen. In gesetzlichen Vorschriften ist festgelegt, dass der Gehalt an verschleppter Wirtszellnukleinsäure unter 10 ng/Dosis eines Impfstoffs auf Basis attenuierter Viren liegen muss. Die Benzonase® Endonuklease-Behandlung mit anschließender Tangentialflussfiltration ist eine robuste und leistungsstarke Kombination zum Abbau und zur anschließenden Entfernung von Rest-Nukleinsäurekomponenten.
Maximierung der Downstream-Rückgewinnung
Die Behandlung mit Benzonase® Endonuklease reicht aus, um den gewünschten Reinheitsgrad für die meisten virusbasierten Impfstoffe während der Konzentration und Diafiltration zu erreichen. Die Chromatographie ist jedoch erforderlich, um die Reinheitsziele für virusbasierte Impfstoffe der nächsten Generation, wie das Japanische Enzephalitis-Virus (JEV) und das Dengue-Virus (DENV), zu erreichen. Da jeder Herstellungsprozess auf die Eigenschaften des Virus zugeschnitten sein muss, ist eine Reihe von Optionen für die nachgelagerte Aufreinigung unerlässlich, um die gewünschte Reinheit zu erzielen und gleichzeitig eine optimale Rückgewinnung zu gewährleisten.
Sicherstellen der Patientensicherheit
Auch wenn virusbasierte Impfstoffe mit attenuierten Viren hergestellt werden, bleibt die Gewährleistung der Patientensicherheit ein wichtiges Anliegen. Das endgültige Volumen des Virusimpfstoffs ist mit dem von Wasser vergleichbar. So kann der Impfstoff vor der Endformulierung und Abfüllung & Fertigstellung durch eine 0,22-µm-Sterilfiltration sterilisiert werden.
Workflow
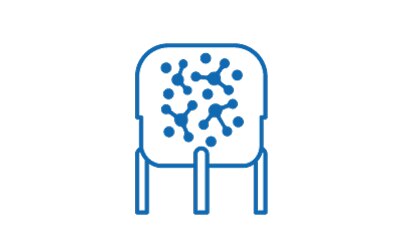
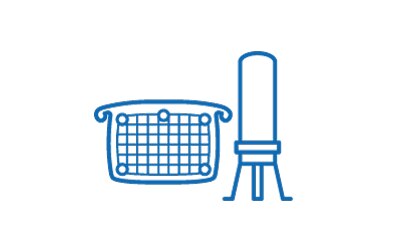
Nuklease-Behandlung & Klärfiltration
Sicherstellen einer robusten Skalierbarkeit
- Nukleasebehandlung mit Benzonase® geeignet für die biopharmazeutische Produktion EMPROVE® bio
- Benzonase® Nachweis mit Benzonase® Elisa-Kit II zum Nachweis von Benzonase® Endonuklease-Resten im Prozess
- Primär-/Sekundär-Klärfiltration mit Millistak+® HC POD-Tiefenfiltern
- Primär-Klärfiltration mit Clarisolve® Tiefenfiltern
- Sekundär-Klärfiltration mit Polysep II-Filterelementen

Flüssige Zellkulturmedien & Puffer für Bioprozesse
Wir verfügen über branchenführende Kapazitäten für sterilfiltrierte Flüssigkeiten höchster Qualität und liefern gebrauchsfertige Zellkulturmedien, Puffer, CIP- und SIP-Produkte aus GMP-Anlagen weltweit für die Optimierung Ihrer Biopharmaproduktion.

Downstream – Tangentialflussfiltration
Erreichen der angestrebten Ausbeute, Effizienz und Virusrückgewinnung bei gleichzeitiger Sicherstellung einer zuverlässigen Abscheidung von Verunreinigungen
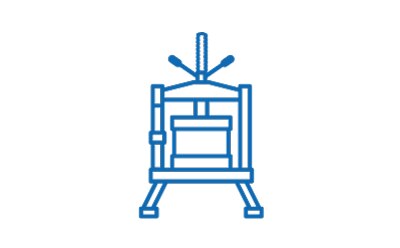
Downstream – Chromatographie
- Membranchromatographie mit Eshmuno® Q Harz
- Membranchromatographie mit Natrix® Q Recon Mini Chromatographiemembranen
- Membranchromatographie mit Natrix® Q Pilot Chromatographiemembran
- Capture- und/oder Polishing-Chromatographie mit Fractogel® EMD DEAE Chromatographieharzen
- Capture- und/oder Polishing-Chromatographie mit Fractogel® EMD DEAE Chromatographieharzen

Endständige Sterilfiltration & Abfüllung
Bedenken hinsichtlich der Kreuzkontamination von Produkten ausräumen, Anforderungen an Abfüllung & Fertigstellung optimieren und aktuelle gesetzliche Anforderungen einhalten

Validierung & Prüfdienstleistungen
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?


