T5266
Trypsin aus Schweinepankreas
lyophilized powder, γ-irradiated, BioXtra, suitable for cell culture, 1,000-2,000 BAEE units/mg solid
About This Item
Empfohlene Produkte
Biologische Quelle
Porcine pancreas
Qualitätsniveau
Sterilität
γ-irradiated
Produktlinie
BioXtra
Form
lyophilized powder
Spezifische Aktivität
1,000-2,000 BAEE units/mg solid
Mol-Gew.
23.8 kDa
Konzentration
25 mg/mL
Methode(n)
cell culture | mammalian: suitable
Versandbedingung
wet ice
Lagertemp.
2-8°C
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
Verwandte Kategorien
Anwendung
Biochem./physiol. Wirkung
Serinprotease-Inhibitoren, u. a. DFP, TLCK, APMSF, AEBSEF und Aprotinin, hemmen Trypsin.
Komponenten
Vorsicht
Einheitendefinition
Angaben zur Herstellung
Bei Anwendungen, in denen EDTA verwendet wird, sollte Trypsin in einer gepufferten Salzlösung ohne Ca2+ oder Mg2+ aufgelöst werden.
Signalwort
Danger
H-Sätze
Gefahreneinstufungen
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Zielorgane
Respiratory system
WGK
WGK 1
Persönliche Schutzausrüstung
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Protokolle
This procedure is for products with a specification for Trypsin activity using Na-Benzoyl-L-arginine ethyl ester (BAEE) as a substrate. The procedure is a continuous spectrophotometric rate determination (A253, Light path = 1 cm).
Verwandter Inhalt
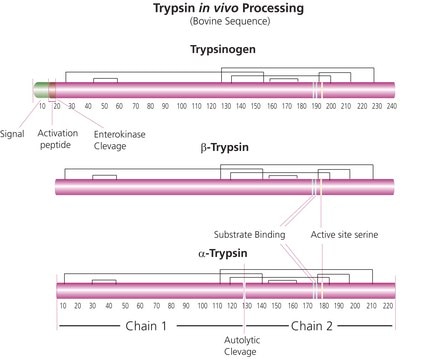
Trypsin is an enzyme in the serine protease class that consists of a polypeptide chain of 223 amino acid residues. Multiple sources, grades and formulations of trypsin specifically designed for research applications are available.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.